Exploring immunological manifestations that facilitate aging and age-related disease susceptibility
מה שקורה מחר 94
BGU researchers have discovered how prolonged exposure to stress can increase the risk of autoimmune diseases
BEER-SHEVA, Israel, April, 2013 – Chronic stress increases the susceptibility to an autoimmune disease similar to multiple sclerosis, which is characterized by damage to the nervous system as a result of a directed attack by the immune system on the myelin coating of the nerve cells in the brain, Ben-Gurion University of the Negev researchers have proven. The researchers, Dr. Idan Harpaz and Prof. Alon Monsonego, in conjunction with Prof. Hagit Cohen, characterized for the first time the leading mechanisms which cause damage to immunoregulatory functions of the immune system in mice under chronic stress.
The researchers’ findings were recently published in the European Journal of Immunology. The researchers showed that the phenomenon is caused, among other things, by damage to release adequate levels of glucocorticoids (steroid hormones termed cortisol in humans and corticosterone in rodents) in response to stimulus and more importantly due to a lack of sensitivity in specific cells of the immune system, which cause pathogenic inflammation, to glucocorticoids. As a result, glucocorticoids cannot effectively inhibit the cells that encourage inflammation, which is what usually happens. Moreover, the researchers showed that exposure to high levels of glucocorticoids in those suffering from chronic stress reduced the number of immune cells in such a way that increased the number of cells that encourage pathogenic inflammation compared to those that inhibit it. It is important to note, that the mechanisms appeared more significantly in females than in males and may explain, in part, the higher rates of autoimmune disease in women than in men. The researchers developed their findings through experiments on mice.
Exposure to stress is one of the most common sources of damage both physically and emotionally. The reaction to stress is characterized by the release of important hormones such as glucocorticoids (released following brain signaling to the adrenal cortex; the hypothalamic-pituitary-adrenal axis) that enable the organism to handle stressful situations (fight or flight). At the same time, high levels of glucocorticoids in those suffering from chronic stress harm the body’s immune system and its ability to adequately cope with immune challenges essential to gain homeostasis.
Altogether, the results of the current study suggest that while a high level of glucocorticoids generally protect against the worsening of autoimmune diseases, for those under chronic stress, such treatment could lead to a worsening of the symptoms of the autoimmune disease. Therefore, even though steroids is one of the treatments for chronic inflammation, use of such a treatment, particularly in patients suffering from chronic stress, should be carefully weighed and considered.
The researchers believe that testing the function of the HPA axis can be an important diagnostic tool that can be used to determine how well the immune system is operating. The researchers are also investigating the effects of glucocorticoids in aging and age-related neurodegenerative diseases, such as Alzheimer’s, and report that there is apparently a connection between the effects of glucocorticoids on the immune system and aging.
Monsonego and Harpaz are from the Shraga Segal Department of Microbiology and Immunology in the Faculty of Health Sciences. Monsonego is also a member of the National Institute for Biotechnology in the Desert. Cohen is the head of the Anxiety and Stress Research Unit, Division of Psychiatry, Faculty of Health Sciences.
חוקרים מאוניברסיטת בן גוריון גילו כיצד חשיפה ממושכת ללחץ יכולה להעלות את הסיכויים לחלות במחלות אוטואימוניות ולהחריפן
חשיפה לתנאי לחץ (סטרס) הוא אחד הגורמים השכיחים ביותר הגורמים לפגיעה בגוף ובנפש. חשיפה לסטרס גורמת להפרשת הורמונים חשובים כדוגמת קורטיקוסטרואידים (קורטיזול באדם וקורטיקוסטרון במכרסמים), המאפשרים לאורגניזם להתמודד עם הסכנה בה הוא נמצא (Fight or flight responses) ומהווה את אחד המנגנונים החשובים להישרדותו של הפרט. יחד עם זאת, כאשר החשיפה לתנאי לחץ הינה ממושכת, היא עלולה לגרום לפגיעה סיסטמית במערכות הגוף בכלל ולתפקודה התקין של מערכת החיסון בפרט. אכן, ברוב המחקרים שנעשו עד כה, השראת לחץ פיסיולוגי או פסיכולוגי מתמשך גרם לירידה בתפקוד מערכת החיסון ולעליה ברגישות לתחלואה במחלות זיהומיות. דיכוי מערכת החיסון בעקבות חשיפה לתנאי לחץ מתווכות על ידי הפעלת ציר ה-HPA (Hypothalamic-pituitary-adrenal axis) שבסופו מופרשים קורטיקוסטרואידים מבלוטת יותרת הכליה אשר ידועים ביכולתם לדכא תאים מעודדי דלקת ועל כן מהווים מרכיב חשוב ביותר בשימוש הרפואי לדיכוי מערכת החיסון במצבים של דלקות כרוניות ובמחלות אוטואימוניות. הבקרה על התהליך הדלקתי הינה קריטית שכן חוסר יכולת ביצירת דלקת אינה מאפשרת התמודדות עם חידקים ווירוסים מחוללי מחלה מחד אך חוסר בקרה על התהליך הדלקתי עלול לגרום לנזק רקמתי ומעלה את הסבירות לחלות במחלות לב, סרטן, דלקות פרקים, אלצהימר, מחלות אוטואימוניות ועוד.
למרות ההשפעה המדכאת של חשיפה לתנאי לחץ על מערכת החיסון, הצטברו במהלך השנים האחרונות מספר עדויות לכך שחשיפה לתנאי לחץ מתמשכים הן בבני אדם והן במודלים עכבריים מעלה את הרגישות לחלות במחלות אוטואימוניות, אשר באופן פרדוקסלי מאופיינות בתגובת יתר של מערכת החיסון כנגד הגוף עצמו דבר הבא לידי ביטוי בתגובות דלקתיות חריפות שאינן מרוסנות. יחד עם זאת, המנגנונים האחראיים לפגיעה בבקרה על פעילות מערכת החיסון כתוצאה מחשיפה לתנאי לחץ מתמשכים אינם ידועים.
במאמר שפורסם לאחרונה “Chronic exposure to stress predisposes to higher autoimmune susceptibility in C57BL/6 mice: Glucocorticoids as a double-edged sword” בירחון המדעי Journal of European immunology דר’ הרפז עידן ופרופ’ אלון מונסונגו, בשיתוף עם פרופ’ חגית כהן מאוניברסיטת בן גוריון בנגב, אפיינו לראשונה את המנגנונים המובילים לפגיעה בבקרה על פעילותה של מערכת החיסון בעכברים בעקבות חשיפה ממושכת לסטרס. החוקרים הראו כי חשיפה ממושכת לסטרס העלתה את הרגישות לחלות במחלה המדמה טרשת נפוצה המאופינת בהתקפה מכוונת של מערכת החיסון כנגד שכבת המיילין העוטפת את תאי העצב במח דבר הגורם לפגיעה בהולכה העצבית. החוקרים הראו כי תופעה זו נובעת, בין היתר, כתוצאה מפגיעה ביכולת ההפרשה של קורטיקוסטרון בתגובה לגירוי ולעמידות תאי מערכת החיסון המעודדים דלקת בפני היכולת המדכאת של גלוקוקורטיקואידים. כתוצאה מיכך, בעקבות חשיפה ממושכת לסטרס, גלוקוקורטיקואידים המופרשים בצורה דרמתית בעקבות דלקת אינם יכולים לעכב באופן יעיל את התאים המעודדים דלקת כפי שמתרחש במצב נורמלי בו תאי מערכת החיסון רגישים לגלוקוקורטיקואידים דבר שעלול כאמור להחריף את התהליך הדלקתי ובכך את הנזק. יתרה מיכך, החוקרים הראו כי חשיפה לרמות גבוהות של גלוקוקורטיקואידים במהלך החשיפה לסטרס הפחיתו את מספר תאי מערכת החיסון באופן יחודי דבר שהביא לעליה ביחס בין תאים המעודדי דלקת לבין אלו שמרסנים אותה. יש לציין כי החוקרים בראשותם של דר’ הרפז עידן ופרופ’ אלון מונסונגו חוקרים את מעורבות הקורטיקוסטרואידים גם במהלך הזיקנה ובמחלות ניווניות תלויות זקנה כגון מחלת האלצהיימר ומדווחים כי כנראה ישנו קשר בין יכולת הבקרה של קורטיקוסטרואידים על מערכת החיסון ובין תהליך ההזדקנות.
תוצאות אלו מציעות כי בעוד רמה גבוהותה של קורטיקוסטרון במצב מנוחה מהווה גורם מגן מפני תהליכים המחריפים מחלות אוטואימוניות, חשיפה מוגברת לתנאי לחץ באופן מתמשך ועליה כרונית ברמות קוקטיקוסטרון גורמת לפגיעה במנגנוני בקרה מרכזיים המפקחים על פעילותם של תאי מערכת החיסון, דבר העלול לגרום לעליה בשכיחותן והחרפתן של מחלות אוטואימוניות. לכן, למרות שסטרואידים מהווים את אחד מדרכי הטיפול השכיחים ביותר במחלות דלקתיות כרוניות/מחלות אוטואימוניות, שימוש בסטרואידים בחולים במחלות אלו והחשופים לתנאי לחץ כרוניים בחייהם צריך להישקל ביתר זהירות על מנת למנוע את החרפת המחלה.
ילדים כמעט ולא נפגעים מקורונה, והסיבה לכך עשויה להציל מבוגרים רבים (הארץ)
לעצור את הזמן: חוקרים ישראלים הניחו את האצבע על השלב בו מערכת החיסון ‘מתקלקלת’ ומאיצה את תהליך ההזדקנות
הארץ – חוקרים גילו מה קורה למערכת החיסון כשמזדקנים
T Cells Lose Their Ability to Adapt as We Age Leading to Illness and Inflammation, Ben-Gurion University Researchers Confirm after Profiling 24,000 T Cells
BEER-SHEVA, Israel, August 22, 2019 – Understanding how T cells combat illness, infection and inflammation could lead to targeted treatments to reduce or eliminate infirmities associated with aging. Ben-Gurion University of the Negev (BGU) biologists have taken a step towards that goal by profiling 24,007 T Cells in young and old mice. T cells control our bodies’ adaptive immune responses.
Their findings were just published in Science Advances.
The researchers from BGU and the National Institute for Biotechnology in the Desert (NIBN) and the Weizmann Institute of Science discovered that there were distinct subsets of CD4 T cells which were significantly altered in older mice. In young mice, the subsets were still able to adapt, whereas in the older mice, about 30% of the subsets had deteriorated in various ways. They believe these findings begin to explain how human beings become prone to a variety of illnesses as they age.
Prof. Alon Monosonego of the Shraga Segal Department of Microbiology, Immunology and Genetics of the Faculty of Health Sciences and the NIBN and Prof. Esti Yeger-Lotem, also of the NIBN and the Department of Clinical Biochemistry and Pharmacology, co-led the study.
“We were able to track the transformation of central elements in the immune system for the first time. Such transformations could expose them to the problems of aging, ” Prof. Monsonego said, “The study’s findings provide new tools to track these changes, and to eventually intervene and correct them.”
“We used a number of computational methods to track gene expression in thousands of cells within the immune system, which gave us a detailed picture of how the immune system changes as we age,” Prof. Yeger-Lotem added. “When we classified the various cells, first computationally and then experimentally, we were surprised to discover types of cells that weren’t previously seen in aging, which demonstrates the change the immune system undergoes as we age.”
However, the emerging picture is complex. Their findings indicated that one subset only present in aged mice promoted inflammation, while another one reduced it. The researchers also marked subsets which had previously been recognized in cancer and chronic inflammation but not in aging. Therefore, while more research is needed, “an intriguing avenue to understand age-related immune failure has been opened.”
Additional researchers from BGU included: Yehezqel Elyahu, Idan Hekselman, Omer Berner, Itai Strominger, Kritika Mittal, Anna Nemirovsky, Ekaterina Eremenko, Assaf Vital, Eyal Simonovsky, and Vered Chalifa-Caspi. Maya Schiller of the Technion collaborated alongside Inbal Eizenberg-Magar and Nir Friedman from Weizmann.
Immune mechanisms in aging and neurodegenerative diseases.
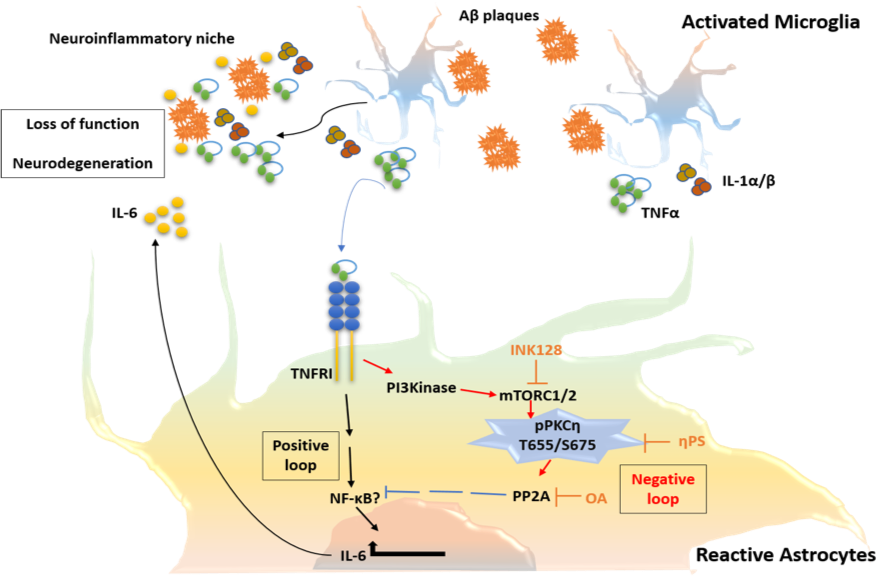
Alzheimer’s disease (AD) is the most common form of dementia, with prevalence progressively increasing with aging. Pathological hallmarks of the disease include accumulation of amyloid-beta (Aβ) peptides and neurofibrillary tangles in the brain associated with glial activation and synpatotoxicity. In addition, AD involves peripheral and brain-endogenous inflammatory processes that appear to enhance disease progression.
Our ongoing studies, using animal models of Alzheimer’s disease, unveil the inflammatory role of microglial subsets, particularly those holding a dialogue with peripheral leukocytes, in the disease process.
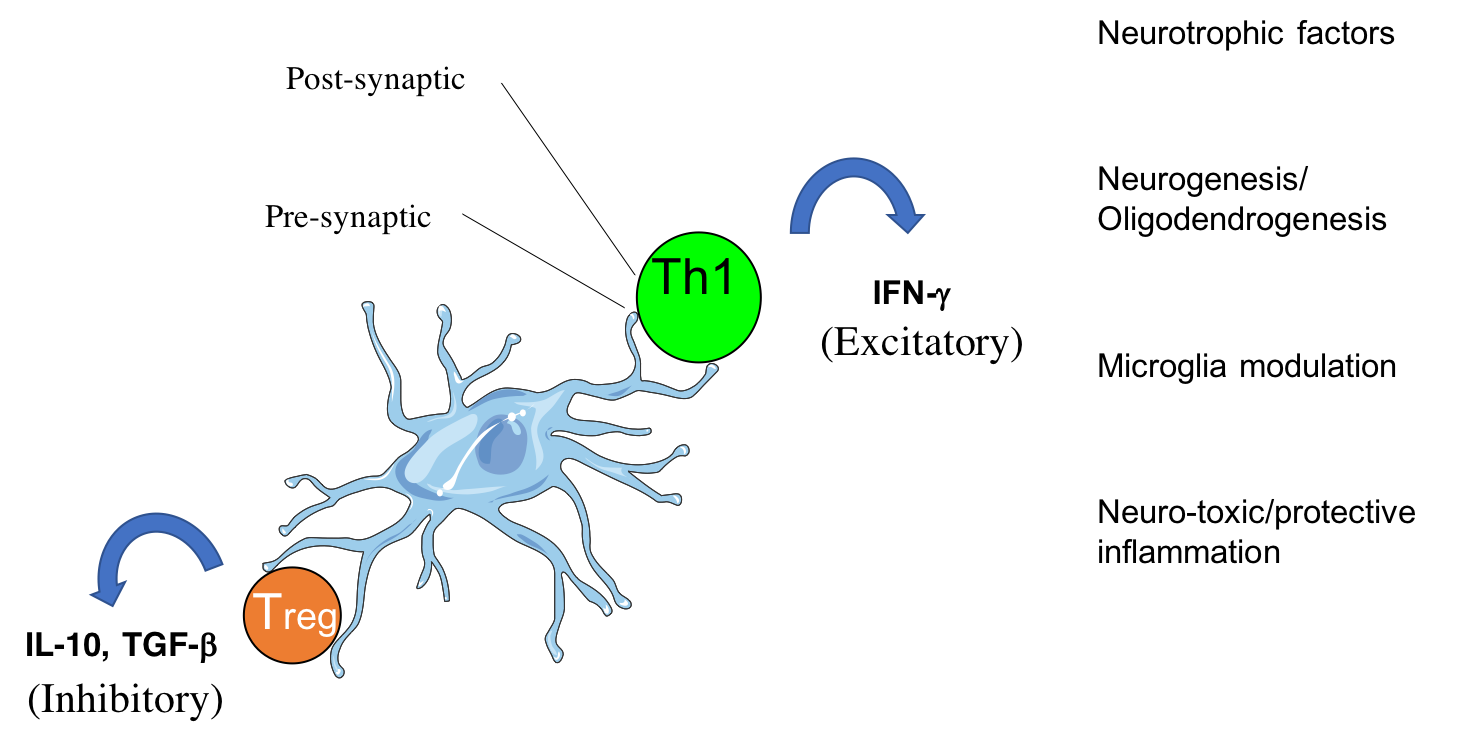
CD4 T cells form cytotoxic or beneficial effector functions within the CNS (Mittal et al., 2019; Eremenko et al., 2019)
In addition, we study how the activation of astrocytes, being key modulators of the blood-brain-barrier and the neuronal network, impacts the disease process.
Apart from activation of an innate immune response in the brain, more than a decade ago a new therapeutic paradigm has emerged for AD, namely the activation of the adaptive immune system directly against the self-peptide Aβ, aiming at lowering its accumulation and neurotoxicity. This was the first time that a brain peptide was used to vaccinate human subjects in a manner similar to classic viral or bacterial vaccines. The vaccination approach took several turns, from initially active to passive and then back to modified active vaccines. As the two first approaches to date failed to show sufficient efficacy, the latter is presently being evaluated in ongoing clinical trials. In the review (CD4 T cells in immunity and immunotherapy of Alzheimer’s disease. Immunology. 2013), we summarize the immunogenic characteristics of Aβ in human and mice and discuss past, present and future Ai-based immunotherapeutic approaches for AD. We emphasize potential pathogenic and beneficial roles of CD4 T cells in light of the general decline in T-cell responsiveness evident in aging. More recently, the studies by Fisher et al., 2014, Strominger et al., 2018, Mittal et al., 2019 and Eremenko et al., 2019, provided mechanistic insights to the migration of CD4 T cells into the choroid plexus and into the brain parenchyma and highlight implications to brain immunity and repair. Current work is devoted to further understanding the dialogue between the immune system and the brain and to generate immunotherapeutic T cells as targeted drug-delivery vehicles.
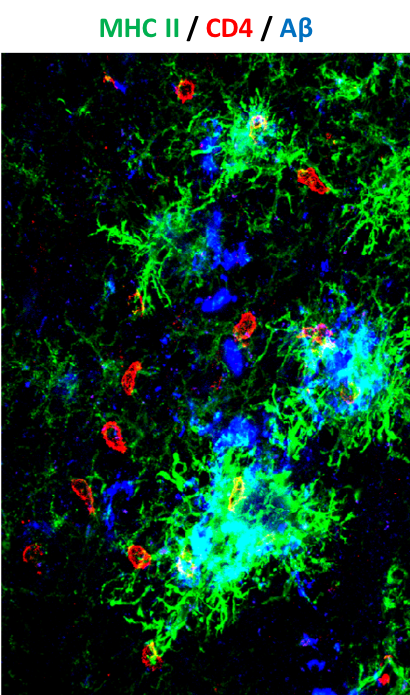
Activated leukocytes (red) attack amyloid plaques in the brain of a mouse model of Alzheimer disease
(Strominger et al., 2018)
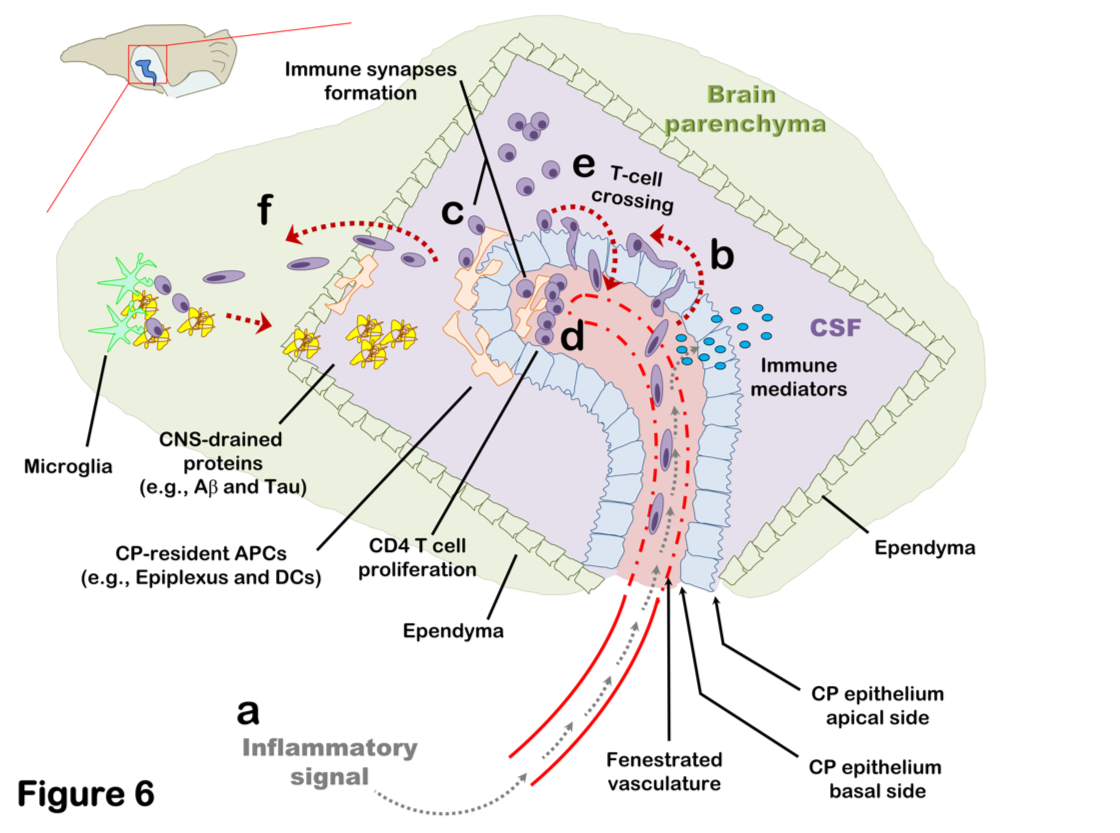
Brain-Immune interactions at the choroid plexus: A semi-lymphoid structure that regulates brain inflammation
(Strominger et al., 2018; Mittal et al., 2019; Eremenko et al., 2019)
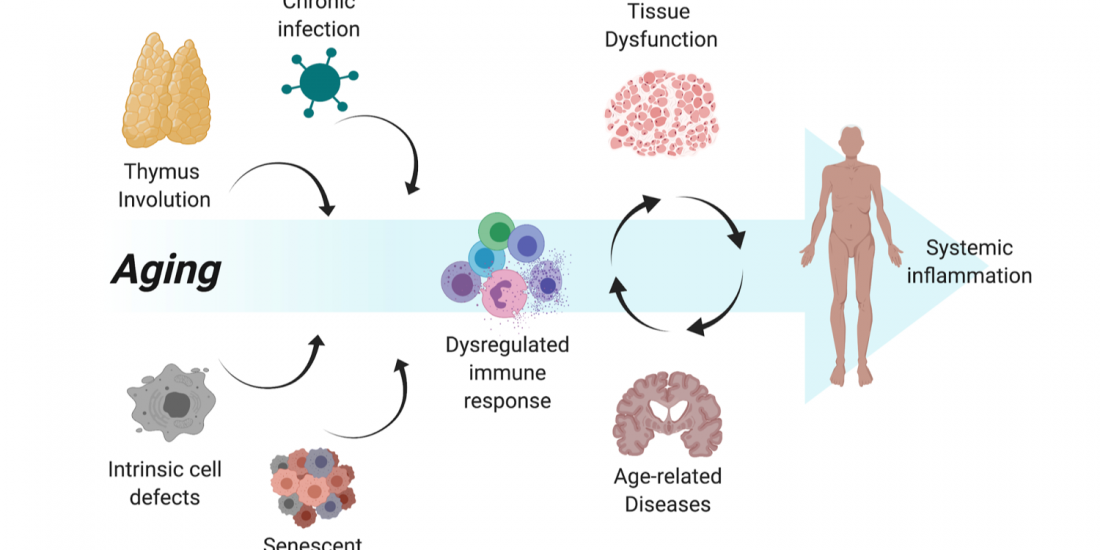
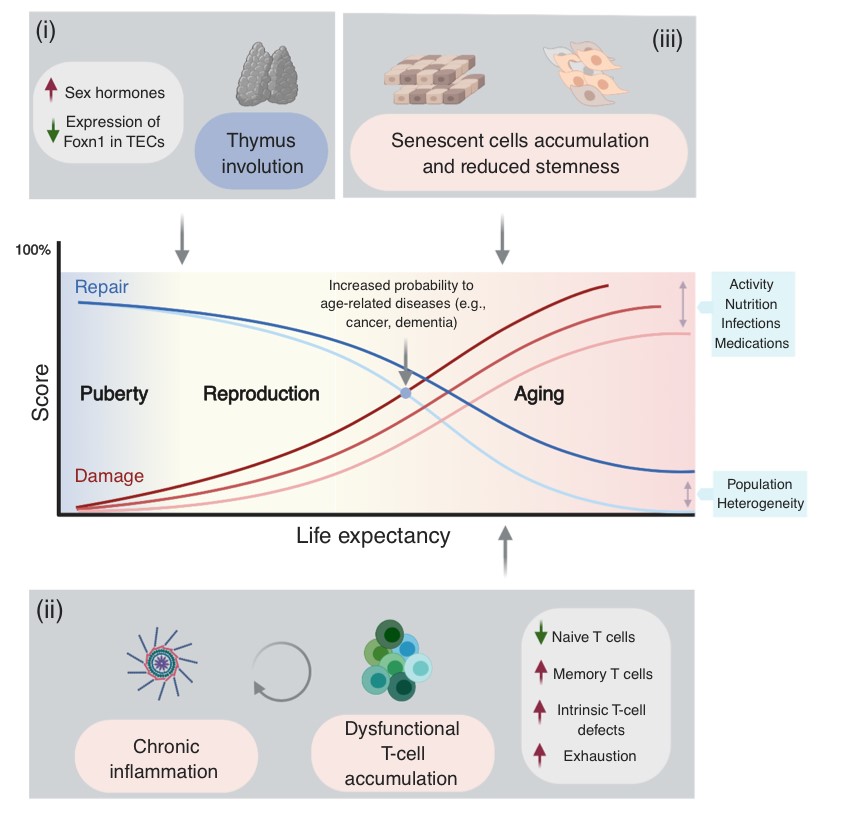
Immune biomarkers of aging and age-related diseases
Among the many possible aging-related factors involved in the development of age-related diseases, senescence of the immune system may significantly enhance inflammation and neuronal damage in the brain and thus facilitate cognitive decline. A direct consequence of immunosenescence is the increased frequency of systemic infections and, in fact, many who die with AD have previously suffered from a severe infection and/or chronic inflammation.
While chronic brain inflammation progresses throughout the disease, the specific arm of the immune system, i.e., brain-specific lymphocytes, may also be stimulated. In contrast to previous assumptions, our findings in people with AD demonstrated that a specific immune response to A-beta is indeed significantly induced in both elderly individuals and patients with AD as compared to middle-aged individuals (Monsonego et al., 2003). The nature and role of this immune response to A-beta is yet to be investigated, and may result in new diagnostic and immunotherapeutic approaches. More recently we have shown that aging results in the accumulation of effector CD4 T cells exhibiting extremely dysregulated functions (Harpaz et al., 2017). Since these dysregulated T cells may significantly impact inflammatory processes in the brain of people with AD, in collaboration with Prof. Esti Yeger-Lotem and Prof. Nir Friedman we initiated a single-cell RNA analysis of leukocytes to reveal how aging impacts the landscape of lymphocytes as a key process that may underlie declined immunity and chronic inflammation in the elderly (Elyahu et al., 2019; Elayhu et al., 2020). Current research aims to further reveal the cellular and molecular characteristics of dysregulated CD4 T cells in aging and neurodegenerative processes both in human and in animal models.
Immune cell residence and function within the central nervous system
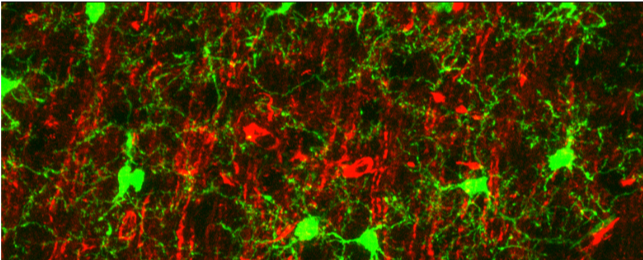
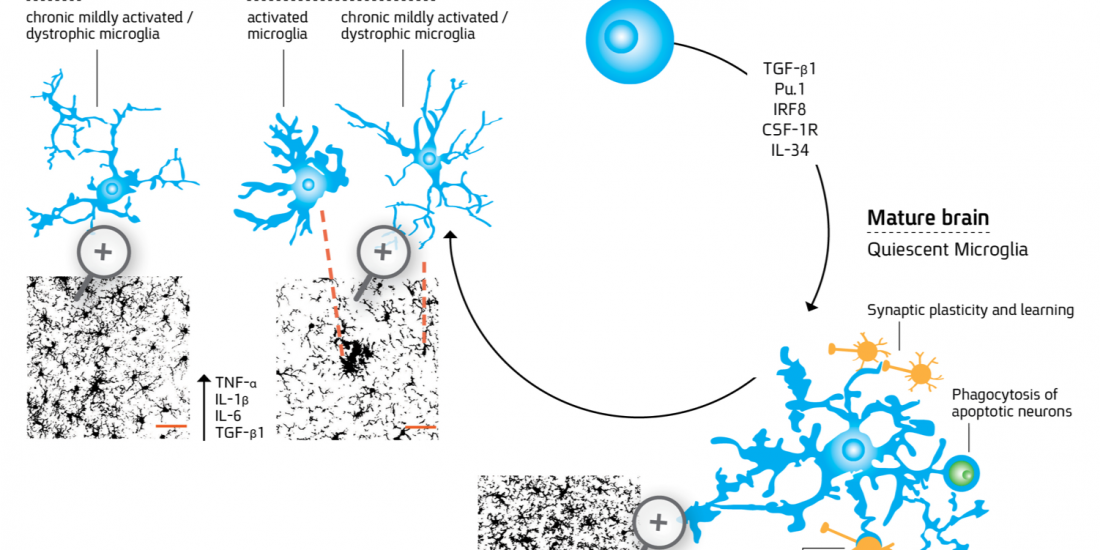
Microglia are myeloid-derived cells that colonize the central nervous system (CNS) already at early stages of development and constitute up to 20% of the glial populations throughout life. While extensive progress has been recently made in identifying the cellular origin of microglia, the mechanism whereby the cells acquire the unique ramified and quiescent phenotype within the CNS milieu and the changes the cells undergo in aging and through the course of CNS disorders requires further research. For more details about microglial differentiation and their role in disease see the following references: Abutbul et al., 2012, Baron et al., 2014; Andreasson KI et al., 2016.
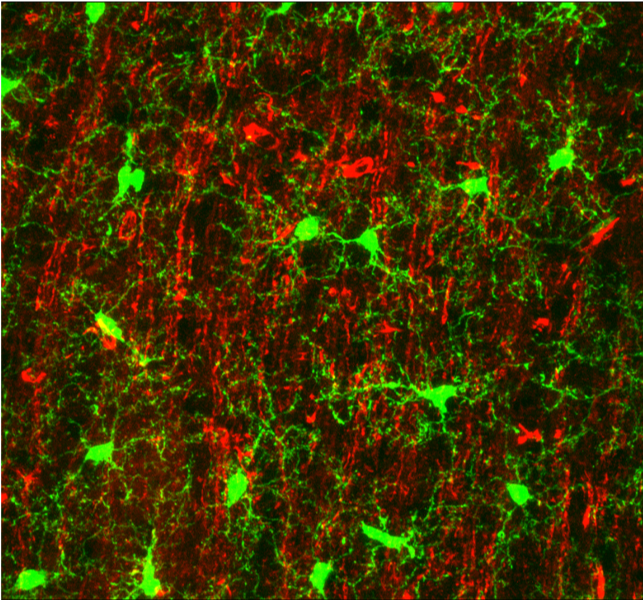
Microglia processes (green) form contacts with neurons (red) in the healthy brain
(Baron et al., 2014)
Our current studies are targeted to reveal the differentiation of microglia at early stages of embryogenesis using genetically-modified zebrafish (in collaboration with Dr. Niva Russek-Blum, The Dead Sea and Arava Science center). In addition, we study the functional properties of the cells in animal models of neurodegenerative diseases (for more details see “Immune mechanisms in aging and neurodegenerative diseases”).